Know how от немецких специалистов: верификация диагноза, госпитализация и сортировка при нехватке ресурсов
Как отделить пациентов с COVID-19 от всех остальных, на что ориентироваться при принятии решения о госпитализации, наконец, чем руководствоваться, распределяя дефицитные ресурсы здравоохранения между больными?
В настоящее время верификация диагноза COVID-19 затруднена как вследствие ограниченности ресурсов, так и особенностей методов, поэтому инфекцию далеко не всегда удается выявить с их помощью. Данная проблема не обходит стороной и немецких медиков, что подвигло инфекционистов из клиники Рехтс дер Изара (Klinikum rechts der Isar) в Техническом университете Мюнхена (vom der Technischen Universität München — TUM) предложить алгоритм сортировки пациентов, опубликованный в «Lancet» (рисунок).
РИСУНОК
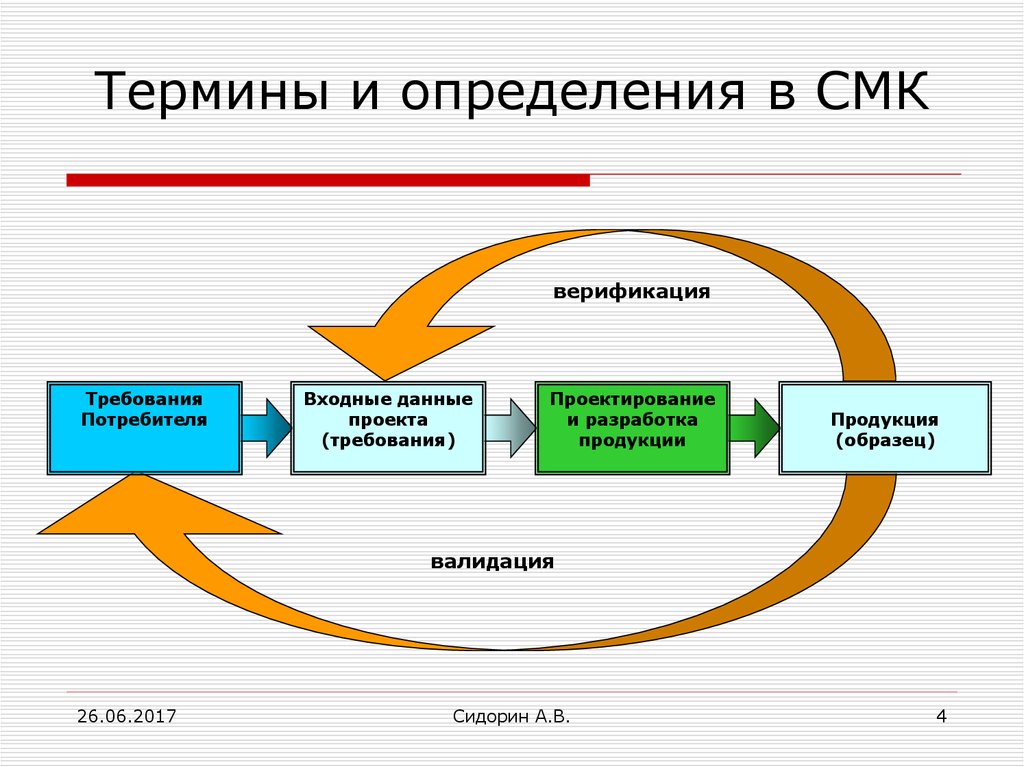
Дифференциальная диагностика пациентов с COVID-19
Температура тела, лимфопения и КТ
Температура тела выше 37,3 °С и уровень лимфоцитов <1,1 г/л — важные дифференциально-диагностические параметры при подозрении на COVID-19.
Если результаты КТ характерны для пневмонии вирусной этиологии, в текущей эпидемиологической ситуации диагноз COVID-19 весьма вероятен. Эти люди после исключения гриппозной и респираторно-синцитиально-вирусной (РСВ) инфекции будут лечиться как пациенты с COVID-19, пока не будет получен отрицательный результат молекулярной диагностики. «Иногда в некоторых клиниках до получения результатов из лабораторий требуется 2–3 дня, — пояснили мюнхенские специалисты. Этот подход, основанный на 3 простых и быстро доступных обследованиях, позволяет обоснованно распределить пациентов в разные когорты».
Рекомендации для семейных врачей
В случае симптомов со стороны респираторного тракта инфекция коронавирусом нового типа (SARS-CoV-2) теперь должна всегда рассматриваться в дополнение к прочим инфекциям респираторного тракта при дифференциальной диагностике.
Врачам общей практики рекомендуют предположить COVID-19 и назначить обследование, если у пациента имеются острые респираторные симптомы и был контакт с подтвержденным случаем за 14 дней до начала заболевания. Обоснованное подозрение на инфекцию SARS‑CoV-2 также возникает, если имеются клинические признаки вирусной пневмонии в связи с пребыванием в учреждении здравоохранения или больнице. Если число случаев продолжит увеличиваться, во многих регионах больше не будет материально-технической возможности подвергать проверке все подозреваемые случаи. При этом требуется изоляция, включающая контактных лиц, телефонное наблюдение и отчет в орган здравоохранения.
В случае серьезных заболеваний рекомендации по госпитализации возможны без предварительного тестирования. Для оценки тяжести пневмонии DEGAM рекомендует индекс CRB-65, клинический балл по статистической вероятности смерти. Он включает следующие критерии:
Для оценки тяжести пневмонии DEGAM рекомендует индекс CRB-65, клинический балл по статистической вероятности смерти. Он включает следующие критерии:
- (C)onfusion: спутанность сознания в связи с пневмонией;
- (R)ate: частота дыхания ≥30/мин;
- (B)lood: артериальное давление диастолическое ≤60 мм рт. ст. или систолическое <90 мм рт. ст.;
- (65)Возраст ≥65 лет.
Возможность госпитализации рассматривают, если хотя бы один из критериев является положительным; необходимой она считается при двух положительных критериях. При этом защита групп риска и практикующих медиков является приоритетом. Последним при появлении признаков респираторного заболевания следует проходить тестирование на COVID-19 и носить маску.
Сортировка — как в медицине катастроф
Федеральная ассоциация врачей скорой помощи в Германии (Bundesvereinigung der Arbeitsgemeinschaften der Notärzte Deutschlands — BAND) отмечает: «Пациенты с острым респираторным заболеванием и подозрением на COVID-19 должны лечиться так же, как и другие, с точки зрения справедливости распределения. Даже если существует региональный недостаток ресурсов, предпочтения или игнорирование, основанные исключительно на календарном возрасте или социальных критериях, неоправданны». Ассоциация предупреждает, что решения в условиях нехватки ресурсов для спасения являются экстремальной эмоциональной и моральной проблемой для команды спасателей. Следовательно, работникам служб неотложной помощи должна быть гарантирована психосоциальная неотложная помощь.
Даже если существует региональный недостаток ресурсов, предпочтения или игнорирование, основанные исключительно на календарном возрасте или социальных критериях, неоправданны». Ассоциация предупреждает, что решения в условиях нехватки ресурсов для спасения являются экстремальной эмоциональной и моральной проблемой для команды спасателей. Следовательно, работникам служб неотложной помощи должна быть гарантирована психосоциальная неотложная помощь.
25 марта семь немецких медицинских ассоциаций приняли каталог рекомендаций для действий, о чем сообщает Frankfurter Allgemeine Zeitung (FAZ). В документе отмечается, что «вероятно, вскоре даже в Германии, несмотря на уже существующее увеличение пропускной способности, больше не будет достаточно ресурсов для интенсивной терапии всех нуждающихся пациентов… Это может привести к конфликтам при принятии решений, касающихся интенсивной терапии». Для их разрешения предложены следующие принципы. «Если больше невозможно принять всех пациентов в критическом состоянии в отделение интенсивной терапии, распределение ограниченных доступных ресурсов должно быть организовано аналогично сортировке в медицине катастроф», — отмечено в заявлении.
На прошлой неделе председатель Европейского совета по этике (Europäischen Ethikrates) Кристиан Вупен (Christiane Woopen) призвала разработать четкие правила для разрешения подобных этических конфликтов. В случае нехватки оборудования для интенсивной терапии врачам придется решить, кого можно спасти, объяснил медицинский специалист по этике в «Spiegel». «При этом, если искусственная вентиляция легких нужна в срочном порядке двум пациентам, но устройство при этом только одно, его должен получить тот, у кого больше шансов на выживание, — трудное решение», — пояснила К. Вупен.
По материалам aerzteblatt.de; spiegel.de
Валидация медицинского оборудования: виды, этапы, преимущества услуги
Валидация в медицине — это важная контрольная процедура, помогающая установить эффективность различных препаратов или технических приборов после передачи их заказчику.
Проводить подобные процедуры необходимо при установке любых, даже самых высокотехнологичных приборов, поскольку ни один из них не застрахован от сбоев и ошибок. Вовремя выполненная валидация оборудования поможет установить стабильность его функционирования после проведенной настройки и наладки.
Когда требуется контрольная процедура
Валидация медицинских устройств и агрегатов необходима в целом ряде ситуаций:
- после монтажа новой техники на объекте;
- по завершению ремонтных работ вышедшего из строя оборудования;
- после изменений, внесенных в технологические процессы;
- в случаях, когда техника была перемещена на другое место производственной площадки;
-
после любых изменений, внесенных в техдокументацию и методику.
Протокол валидации в медицине: что это такое и каких видов бывает
По результатам выполненных исследований формируется валидационный протокол. Он состоит из трех частей, где отображаются квалификации монтажа, операций и эксплуатации. Для отдельных видов приборов выполняется только одно из перечисленных испытаний. Квалификация эксплуатации необходима преимущественно для производственных систем.
В случаях, когда работоспособность приборов можно определить только одним показателем, требуются операционная и монтажная квалификации. Подобные испытания необходимы, например, холодильным и морозильным камерам, устройствам для измерения pH и центрифугам. Все три квалификации, связанные с монтажом, операциями и эксплуатацией, требуются стерилизационным агрегатам, а также производственным установкам, отвечающим за подачу воды, пара и воздуха.
Валидация приборов для фармацевтического склада: особенности услуги
Каждый фармацевтический склад, хранящий лекарственные препараты, должен обеспечить сохранность их первоначальных свойств. Для этого требуется:
Для этого требуется:
- обеспечить оптимальный режим температуры и влаги;
- защитить продукцию от воздействия солнечных лучей;
- предусмотреть достаточный уровень вентиляции.
При несоблюдении этих требований лекарственные препараты потеряют заявленные качества и станут непригодными для применения. Чтобы обеспечить подходящие условия их хранения, на фармацевтических складах размещаются климатические установки, системы вентиляции, холодильные и морозильные камеры. Проверить корректное функционирование всех этих приборов как раз и призвана валидация. Она помогает доказать или же наоборот опровергнуть соответствие показателей микроклимата предусмотренным параметрам. Необходимость выполнения таких мероприятий прописана в международных требованиях.
Процедура «validation» требуется установкам и приборам, имеющим важное значение для работы фармацевтического склада. К ним относится оборудование, влияющее на показатели микроклимата и иные условия, от которых зависит безопасность и сохранность медикаментов. Важно помнить, что вся техника, размещенная на фармацевтических складах, должна в бесперебойном режиме поддерживать оптимальные показатели температуры и влажности. Это необходимо, чтобы исходные качества лекарственных препаратов оставались неизменными.
К ним относится оборудование, влияющее на показатели микроклимата и иные условия, от которых зависит безопасность и сохранность медикаментов. Важно помнить, что вся техника, размещенная на фармацевтических складах, должна в бесперебойном режиме поддерживать оптимальные показатели температуры и влажности. Это необходимо, чтобы исходные качества лекарственных препаратов оставались неизменными.
Как выполняется валидация фармацевтического склада
Цель такой процедуры — документально подтвердить соблюдение на объекте всех необходимых требований для хранения медикаментов. Валидация проводится дважды в год — в холодный и теплый сезон. Если процедура выполняется зимой, проверяется насколько фармацевтический склад обогревается воздухом, если летом — то акцент делается на охлаждении помещений. Чтобы получать точные результаты о работе техники, желательно проводить валидацию еще и в межсезонье.
По итогам выполненных процедур владелец фармацевтического склада получает необходимые данные, которые позволяют установить подходящий режим настройки климатических приборов и определить критические места для размещения устройств по измерению параметров температуры и влажности.
Этапы валидации
Контрольная процедура медицинского оборудования на объектах, предназначенных для хранения медикаментов, выполняется в следующем порядке:
- Квалификация проекта. На этом этапе анализируются исходные документы и определяются грубые просчеты, которые после установки оборудования устранять затратно или невозможно.
- Квалификация монтажа. Дойдя до этой стадии, специалисты проверяют объект визуально, сравнивая фактическую информацию со спецификацией. Мониторингу подвергаются такие аспекты, как соответствие приборов техническим требованиям, а также наличие у владельца склада полного пакета документов на медицинское оборудование. Квалификация монтажа необходима фармацевтическим комплексам, возведенным впервые или прошедшим реконструкцию.
-
Квалификация функционирования. На объекте монтируются беспроводные датчики, показывающие показатели температуры и влажности. Такие процедуры помогают выявить участки, где чаще всего случаются температурные перепады.

Если в ходе квалификации функционирования устанавливаются показатели, не соответствующие предусмотренным условиям хранения, для корректировки ситуации организуются надлежащие мероприятия. Чтобы удостовериться в их эффективности, выполняют четвертую стадию — квалификацию процесса.
Кто должен проводить валидацию и чем она отличается от верификации
Выполнять контрольную процедуру могут только специализированные компании, имеющие соответствующие лицензии. В противном случае документ о пройденной валидации не будет иметь юридической силы.
В целом, наличие валидационного протокола — обязательное условие для компаний, занимающихся оптовой и розничной торговлей медикаментов, их производством и хранением. Этот документ — важный шаг на пути к получению оптовой фармацевтической лицензии.
При этом важно помнить, что процедура валидации в медицине существенно отличается от верификации. В первом случае речь идет о мероприятиях, направленных на выявление возможных отклонений в работе медицинских устройств после установки на объекте. Во втором — подразумеваются процессы, основная цель которых — проверить работу приборов на соответствие параметрам, заданным на заводе-изготовителе. Иными словами, валидация — это процедура тестирования медицинского оборудования на функциональность перед передачей заказчику. Верификация — это то же самое тестирование, но изучающее устройства на соответствие техническому заданию. Выполняется такая процедура еще до передачи приборов заказчику.
В первом случае речь идет о мероприятиях, направленных на выявление возможных отклонений в работе медицинских устройств после установки на объекте. Во втором — подразумеваются процессы, основная цель которых — проверить работу приборов на соответствие параметрам, заданным на заводе-изготовителе. Иными словами, валидация — это процедура тестирования медицинского оборудования на функциональность перед передачей заказчику. Верификация — это то же самое тестирование, но изучающее устройства на соответствие техническому заданию. Выполняется такая процедура еще до передачи приборов заказчику.
Подтвердить сертификацию | Американский совет медицинских специальностей
Важной частью текущей миссии ABMS является предоставление информации о статусе сертификации врачебной комиссии. Независимо от того, выбираете ли вы врача для личного ухода или выбираете врача для работы в профессиональном штате организации, проверка сертификации совета является важной частью определения знаний и опыта врача в конкретной области медицины.
CertiFACTS для удостоверяющих личность
ПРОВЕРКА ПЕРВИЧНОГО ИСТОЧНИКА
Сертификация имеет значение для пациентов
СЕРТИФИЦИРОВАНА ЛИ МОЯ ВРАЧА
ABMS поддерживает базу данных информации о более чем 940 000 врачей. Эта информация признана Совместной комиссией, Национальным комитетом по обеспечению качества, URAC и другими агентствами как удовлетворяющая требованиям проверки первоисточника (PSV), необходимой профессиональным организациям. Он ежедневно обновляется информацией от всех 24 советов членов ABMS.
ABMS предлагает эти способы населению, больницам, поставщикам медицинских услуг, планам медицинского страхования и другим профессиональным организациям , чтобы узнать, сертифицирован ли врач советом и поддерживает ли свои знания и навыки в актуальном состоянии посредством мероприятий по непрерывной сертификации (MOC).
Служба для пациентов и их семей:
Вопросы сертификации Когда вам или члену вашей семьи требуется медицинская помощь, вам нужен высококвалифицированный врач в качестве партнера по медицинскому обслуживанию. Выбирая врача, сертифицированного одним из советов членов ABMS, вы можете быть уверены, что он или она квалифицированы и хорошо осведомлены, являются экспертами в своей области и соответствуют более высоким стандартам, разработанным их коллегами. Используйте сертифицирован ли мой врач? поищите услугу на сайте Certification Matters , чтобы проверить статус сертификации вашего врача.
Выбирая врача, сертифицированного одним из советов членов ABMS, вы можете быть уверены, что он или она квалифицированы и хорошо осведомлены, являются экспертами в своей области и соответствуют более высоким стандартам, разработанным их коллегами. Используйте сертифицирован ли мой врач? поищите услугу на сайте Certification Matters , чтобы проверить статус сертификации вашего врача.
Продукты для проверки первичного источника:
Решения ABMS Аттестация — это процесс получения, проверки и оценки квалификации, фона и легитимности лицензирования, образования и подготовки врачей. Это подтверждает, что врач квалифицирован и компетентен для предоставления качественных медицинских услуг. Чтобы убедиться, что информация, полученная для проверки подлинности, является точной, используется проверка основного источника или PSV. ABMS Solutions предлагает CertiFacts Online и другие продукты для PSV, а также информацию, которая поможет специалистам по сертификации быстро, удобно и безопасно проверить сертификацию врачебной комиссии.
Информация о праве на участие в Совете директоров, целевой практике и повторной проверке
- Политика приемлемости совета директоров ABMS для сертификации по специальности и узкому направлению позволяет советам членов ABMS устанавливать параметры того, как кандидаты могут использовать термин «соответствующий требованиям совета» для обозначения своей подготовки к начальной сертификации. См. Таблицу [PDF] «Периоды участия в совете директоров и даты перехода» для получения информации о периодах участия в совете директоров и датах перехода.
- Обозначение специализированной практики позволяет советам участников ABMS устанавливать стандарты, оценивать и признавать дополнительный опыт, который врачи получают благодаря клиническому опыту, и может включать формальное обучение. Чтобы узнать о разнице между сертификацией узкой специальности и обозначением специализированной практики, см. Различия между сертификацией узкой специальности и обозначением специализированной практики, таблица 9.
 0034 [PDF] . См. таблицу Обозначения специализированной практики [PDF] для получения списка утвержденных обозначений.
0034 [PDF] . См. таблицу Обозначения специализированной практики [PDF] для получения списка утвержденных обозначений. - Советы участников ABMS, которые исключили даты окончания действия сертификатов, признают, что некоторым организациям все еще может потребоваться дата для завершения проверки основного источника. Чтобы обеспечить точный статус сертификации, Советы участников указывают ежегодную дату повторной проверки. Статус сертификации врача будет меняться только один раз в год, если только сертификат не будет отозван по дисциплинарным причинам. ABMS рекомендует повторно проверять статус этих врачей в день или после даты повторной проверки, указанной в таблице «Даты окончания и даты повторной проверки» 9.0034 [PDF] . В этой таблице представлена сводка дат окончания срока действия сертификата членского совета ABMS, времени действия и даты повторной проверки, чтобы помочь в процессе аттестации.
Нужна проверка основного источника? Узнайте о решениях ABMS и CertiFACTS.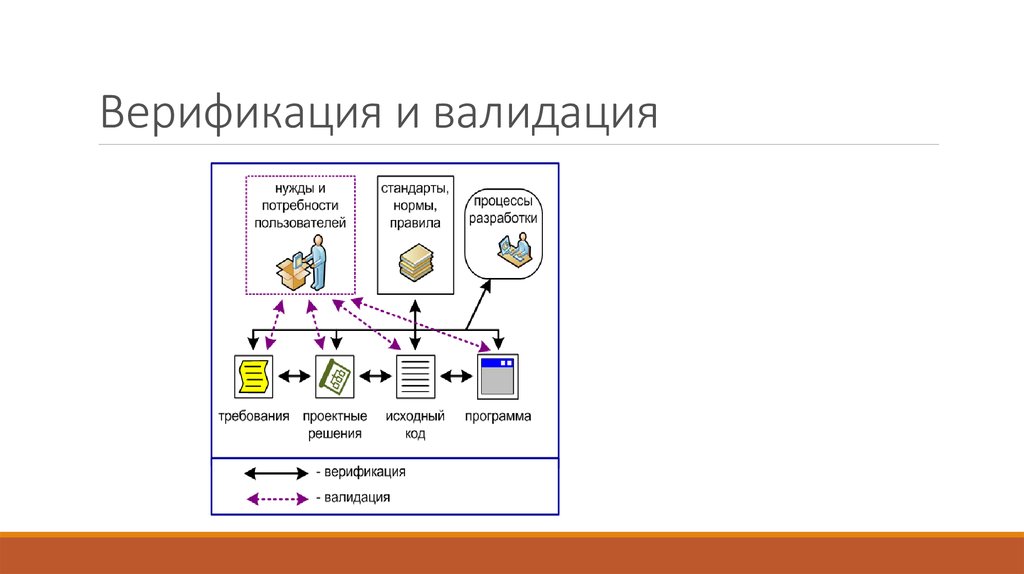
Что такое верификация и валидация при разработке медицинских изделий? —
Мероприятия по проверке и валидации конструкции медицинского изделия (называемые «Этап 3» и «Этап 4» в GCMI) обычно проводятся после этапа проектирования (называемого «Этапом 2» в GCMI). По завершении этапа проектирования продукт будет иметь четко определенные входные данные для проектирования, а также полностью описанные конструктивные особенности и методы производства. Проверка и валидация проекта затем берут этот проектный результат (продукт) и гарантируют, что он соответствует всем инженерным требованиям и потребностям пользователей, соответственно.
Проверка проекта гарантирует, что команда сделала продукт «правильным» — в соответствии с техническими требованиями. А проверка дизайна гарантирует, что вы сделали «правильный» продукт — в соответствии с потребностями клиента.
Каковы цели проверки и проверки?
Верификация и валидация проекта (DV&V) часто завершаются физическими испытаниями, но могут также включать другие методы, такие как проверки, обзор спецификаций или анализ материалов. Типичный процесс для DV&V начинается с создания плана тестирования и анализа, перечисления всех входных данных проекта и определения того, как они будут проверяться и подтверждаться. Затем команда проекта документирует подробный протокол выполнения каждого теста или анализа, включая измеримые критерии приемлемости. После завершения оценок все данные и выводы заносятся в формальные отчеты. Все эти документы каталогизированы в файле истории разработки устройства.
Типичный процесс для DV&V начинается с создания плана тестирования и анализа, перечисления всех входных данных проекта и определения того, как они будут проверяться и подтверждаться. Затем команда проекта документирует подробный протокол выполнения каждого теста или анализа, включая измеримые критерии приемлемости. После завершения оценок все данные и выводы заносятся в формальные отчеты. Все эти документы каталогизированы в файле истории разработки устройства.
Регулирующим органам и аудиторам требуется хорошо документированный и завершенный план проверки и проверки, протоколы испытаний и результаты. Этот важнейший набор документации служит доказательством проектной группы для регулирующего органа в том, что продукт безопасен и эффективен. Отчеты DV&V часто предоставляются в письменном виде или в краткой форме непосредственно регулирующему органу.
Регулятор рассмотрит результаты по таким вопросам, как:
- Была ли безопасность медицинского электрического оборудования продемонстрирована в соответствии с международными стандартами, такими как IEC 60601-1?
- Прошел ли продукт, контактирующий с пациентом, все применимые испытания на биологическую безопасность?
- Была ли продемонстрирована производительность продукта даже в наихудшем сценарии?
Какие мероприятия по проверке проекта?
Фото Майка Глатцера Фото #mikeglatzerphotos
Проверка проекта гарантирует, что результаты проектирования продукта соответствуют установленным инженерным требованиям. Существуют различные виды методов тестирования, которые можно применять в зависимости от того, какой аспект устройства находится под оценкой. Физические испытания могут включать механические или электрические лабораторные испытания, лабораторные испытания с использованием биологических тканей, доклинические оценки и т. д.
Существуют различные виды методов тестирования, которые можно применять в зависимости от того, какой аспект устройства находится под оценкой. Физические испытания могут включать механические или электрические лабораторные испытания, лабораторные испытания с использованием биологических тканей, доклинические оценки и т. д.
Проверка дизайна гарантирует, что проект продукта соответствует установленным потребностям пользователя. Потребности пользователей могут быть подтверждены различными способами, включая исследования удобства использования, короткие или длительные доклинические исследования и клинические испытания. Обычно они оценивают взаимодействие пользователя с устройством или его комплексную функциональную производительность. До получения разрешения на начало клинического испытания все остальные испытания должны быть завершены и представлены в регулирующий орган.
Что происходит в конце DV&V?
По окончании успешной проверки и валидации медицинский продукт готов к представлению в регулирующие органы или к маркетингу, в зависимости от нормативной классификации продукта. Обычно следует этап передачи производства, гарантирующий возможность производства высококачественной продукции в достаточных объемах.
Обычно следует этап передачи производства, гарантирующий возможность производства высококачественной продукции в достаточных объемах.
Почему GCMI для проверки и проверки?
Обширный опыт GCMI в области верификации и валидации простирается от разработки уникальных методов испытаний до документирования протоколов и отчетов в соответствии с нормативными требованиями. Мы умеем определять и проводить наилучшие методы тестирования для каждой ситуации. Наша цель — помочь нашим клиентам сделать это правильно с первого раза. GCMI служит вашей комплексной командой по планированию проектов, исследованиям и разработкам, принимая комплексное решение о дизайне продукта и разработке производственного процесса. Наш поэтапный подход дает перспективным технологиям наилучшие шансы на коммерциализацию экономически эффективным способом.
GCMI также имеет «внутреннюю» ведущую в отрасли организацию по контрактным доклиническим исследованиям (CRO). Наш CRO является аккредитованным AAALAC учреждением, которое проводит испытания медицинских изделий на предмет осуществимости, проверки концепции, безопасности и GLP для исследований в любой терапевтической области, а также на малых и больших моделях.