Валидация медицинского оборудования: виды, этапы, преимущества услуги
Валидация в медицине — это важная контрольная процедура, помогающая установить эффективность различных препаратов или технических приборов после передачи их заказчику. В случае с медицинским оборудованием такие мероприятия представляют собой действия, направленные на выявление работоспособности техники после монтажа на производственном объекте.
Проводить подобные процедуры необходимо при установке любых, даже самых высокотехнологичных приборов, поскольку ни один из них не застрахован от сбоев и ошибок. Вовремя выполненная валидация оборудования поможет установить стабильность его функционирования после проведенной настройки и наладки.
Когда требуется контрольная процедура
Валидация медицинских устройств и агрегатов необходима в целом ряде ситуаций:
- после монтажа новой техники на объекте;
- по завершению ремонтных работ вышедшего из строя оборудования;
- после изменений, внесенных в технологические процессы;
- в случаях, когда техника была перемещена на другое место производственной площадки;
-
после любых изменений, внесенных в техдокументацию и методику.

Протокол валидации в медицине: что это такое и каких видов бывает
По результатам выполненных исследований формируется валидационный протокол. Он состоит из трех частей, где отображаются квалификации монтажа, операций и эксплуатации. Для отдельных видов приборов выполняется только одно из перечисленных испытаний. Квалификация эксплуатации необходима преимущественно для производственных систем.
В случаях, когда работоспособность приборов можно определить только одним показателем, требуются операционная и монтажная квалификации. Подобные испытания необходимы, например, холодильным и морозильным камерам, устройствам для измерения pH и центрифугам. Все три квалификации, связанные с монтажом, операциями и эксплуатацией, требуются стерилизационным агрегатам, а также производственным установкам, отвечающим за подачу воды, пара и воздуха.
Валидация приборов для фармацевтического склада: особенности услуги
Каждый фармацевтический склад, хранящий лекарственные препараты, должен обеспечить сохранность их первоначальных свойств. Для этого требуется:
Для этого требуется:
- обеспечить оптимальный режим температуры и влаги;
- защитить продукцию от воздействия солнечных лучей;
- предусмотреть достаточный уровень вентиляции.
При несоблюдении этих требований лекарственные препараты потеряют заявленные качества и станут непригодными для применения. Чтобы обеспечить подходящие условия их хранения, на фармацевтических складах размещаются климатические установки, системы вентиляции, холодильные и морозильные камеры. Проверить корректное функционирование всех этих приборов как раз и призвана валидация. Она помогает доказать или же наоборот опровергнуть соответствие показателей микроклимата предусмотренным параметрам. Необходимость выполнения таких мероприятий прописана в международных требованиях.
Процедура «validation» требуется установкам и приборам, имеющим важное значение для работы фармацевтического склада. К ним относится оборудование, влияющее на показатели микроклимата и иные условия, от которых зависит безопасность и сохранность медикаментов. Важно помнить, что вся техника, размещенная на фармацевтических складах, должна в бесперебойном режиме поддерживать оптимальные показатели температуры и влажности. Это необходимо, чтобы исходные качества лекарственных препаратов оставались неизменными.
К ним относится оборудование, влияющее на показатели микроклимата и иные условия, от которых зависит безопасность и сохранность медикаментов. Важно помнить, что вся техника, размещенная на фармацевтических складах, должна в бесперебойном режиме поддерживать оптимальные показатели температуры и влажности. Это необходимо, чтобы исходные качества лекарственных препаратов оставались неизменными.
Как выполняется валидация фармацевтического склада
Цель такой процедуры — документально подтвердить соблюдение на объекте всех необходимых требований для хранения медикаментов. Валидация проводится дважды в год — в холодный и теплый сезон. Если процедура выполняется зимой, проверяется насколько фармацевтический склад обогревается воздухом, если летом — то акцент делается на охлаждении помещений. Чтобы получать точные результаты о работе техники, желательно проводить валидацию еще и в межсезонье.
По итогам выполненных процедур владелец фармацевтического склада получает необходимые данные, которые позволяют установить подходящий режим настройки климатических приборов и определить критические места для размещения устройств по измерению параметров температуры и влажности.
Этапы валидации
Контрольная процедура медицинского оборудования на объектах, предназначенных для хранения медикаментов, выполняется в следующем порядке:
- Квалификация проекта. На этом этапе анализируются исходные документы и определяются грубые просчеты, которые после установки оборудования устранять затратно или невозможно.
- Квалификация монтажа. Дойдя до этой стадии, специалисты проверяют объект визуально, сравнивая фактическую информацию со спецификацией. Мониторингу подвергаются такие аспекты, как соответствие приборов техническим требованиям, а также наличие у владельца склада полного пакета документов на медицинское оборудование. Квалификация монтажа необходима фармацевтическим комплексам, возведенным впервые или прошедшим реконструкцию.
-
Квалификация функционирования. На объекте монтируются беспроводные датчики, показывающие показатели температуры и влажности. Такие процедуры помогают выявить участки, где чаще всего случаются температурные перепады.

Если в ходе квалификации функционирования устанавливаются показатели, не соответствующие предусмотренным условиям хранения, для корректировки ситуации организуются надлежащие мероприятия. Чтобы удостовериться в их эффективности, выполняют четвертую стадию — квалификацию процесса.
Кто должен проводить валидацию и чем она отличается от верификации
Выполнять контрольную процедуру могут только специализированные компании, имеющие соответствующие лицензии. В противном случае документ о пройденной валидации не будет иметь юридической силы.
В целом, наличие валидационного протокола — обязательное условие для компаний, занимающихся оптовой и розничной торговлей медикаментов, их производством и хранением. Этот документ — важный шаг на пути к получению оптовой фармацевтической лицензии.
При этом важно помнить, что процедура валидации в медицине существенно отличается от верификации. В первом случае речь идет о мероприятиях, направленных на выявление возможных отклонений в работе медицинских устройств после установки на объекте. Во втором — подразумеваются процессы, основная цель которых — проверить работу приборов на соответствие параметрам, заданным на заводе-изготовителе. Иными словами, валидация — это процедура тестирования медицинского оборудования на функциональность перед передачей заказчику. Верификация — это то же самое тестирование, но изучающее устройства на соответствие техническому заданию. Выполняется такая процедура еще до передачи приборов заказчику.
В первом случае речь идет о мероприятиях, направленных на выявление возможных отклонений в работе медицинских устройств после установки на объекте. Во втором — подразумеваются процессы, основная цель которых — проверить работу приборов на соответствие параметрам, заданным на заводе-изготовителе. Иными словами, валидация — это процедура тестирования медицинского оборудования на функциональность перед передачей заказчику. Верификация — это то же самое тестирование, но изучающее устройства на соответствие техническому заданию. Выполняется такая процедура еще до передачи приборов заказчику.
ВЕРИФИКАЦИЯ — Проблема верификации в доказательной медицине
Форум РМС
Лечение в Москве — 8 (495) 506 61 01
Лечение за рубежом — 8 (925) 50 254 50
Виноградов М.А. Московская медицинская академия имени И.М. Сеченова
Термин «медицина, основанная на доказательствах» или «доказательная медицина» (evidence based medicine) появился в лексиконе современных медицинских специалистов совсем недавно, однако за сравнительно небольшой период времени, основные принципы, вкладываемые в значение этого термина, составили доминирующую идеологию медицины XXI века. Возможно, это произошло потому, что современная клиническая медицина увидела в медицине «доказательной» возможный способ выхода из кризиса, в котором она находится с середины ХХ века. С помощью «доказательности» появилась возможность если не сделать медицину точной наукой, то по крайней мере, приблизить её к таковой.
Возможно, это произошло потому, что современная клиническая медицина увидела в медицине «доказательной» возможный способ выхода из кризиса, в котором она находится с середины ХХ века. С помощью «доказательности» появилась возможность если не сделать медицину точной наукой, то по крайней мере, приблизить её к таковой.
Определение, данное в 1993 году Рабочей группой по доказательной медицине, звучит так: «Доказательная медицина – это раздел медицины, основанной на доказательствах, предполагающий поиск, сравнение и широкое распространение полученных доказательств для использования в интересах больных». Таким образом, доказательная медицина является новым подходом, к технологиям сбора, анализа, обобщения и трактовки медицинской информации. Внедрение принципов доказательной медицины в практику здравоохранения предусматривает оптимизацию качества медицинской помощи с точки зрения безопасности, эффективности, стоимости и др. В узком смысле, задача доказательной медицины, – преобразовать результаты научных исследований в конкретные клинические рекомендации для врачей.
Важным аспектом доказательной медицины стало установление степени достоверности и значимости, т.е. «доказательности» медицинской информации. Значимость любого медицинского исследования определяется рядом факторов, среди которых особое место принадлежит научному обоснованию этого исследования и возможности практического применения его результатов. По мнению ряда авторов, именно эти два фактора и составляют основу доказательной медицины [1].

Можно утверждать, что доказательная медицина является логическим продолжением и этапом развития традиционной клинической медицины Запада, ориентированной на принципы позитивизма – философского направления ХХ века, оказавшего огромное влияние на современную науку.
Позитивизм ставит во главу угла тот постулат, что все подлинное, положительное («позитивное») знание о действительности может быть получено лишь в виде результатов отдельных специальных наук или их «синтетического» объединения. Согласно этому принципу, традиционная клиническая медицина обосновывала диагноз исходя из совокупности проанализированных данных, полученных различными дополнительными методами, заимствованными из различных отраслей науки – физическими, химическими, биологическими и т. д. С развитием современных технологий медицинской визуализации, физико-химического анализа, на второй план отошел собственно сам сбор анамнеза, который по сути своей, стал формальностью.
д. С развитием современных технологий медицинской визуализации, физико-химического анализа, на второй план отошел собственно сам сбор анамнеза, который по сути своей, стал формальностью.
Антитеоретическая направленность позитивизма привела к появлению устойчивого мнения о том, что «настоящая» наука может опираться только на факты, а теория должна служить лишь для систематизации и классификации этих фактов. Отсюда убеждение, что на основании методов клинического наблюдения можно сделать лишь отдельные умозаключения о фактах, но не обобщенные гипотезы. Недостаток теоретических обоснований традиционной медицины привел к появлению многочисленных бесполезных и даже противоречащих принципам логики классификаций, а следование методологическим традициям позитивизма привело к явлениям классического атомизма, ассоциационизма, механицизма и крайнего эмпиризма в медицине. В качестве примера можно привести классические учебники, в которых патология базируется на разделении её на элементы (атомизм), существующие отдельно или соединенные друг с другом по принципу ассоциации (ассоциационизм). Для воплощения идеи, требующей исходить из данного в опыте, применяется метод клинического наблюдения, который должен стать непосредственной проверкой отдельных суждений («атомов» знания) путем сравнения с элементарными единицами опыта (эмпиризм) [6].
Для воплощения идеи, требующей исходить из данного в опыте, применяется метод клинического наблюдения, который должен стать непосредственной проверкой отдельных суждений («атомов» знания) путем сравнения с элементарными единицами опыта (эмпиризм) [6].
Накопление больших массивов данных в результате многочисленных клинических исследований привело к избытку частной информации, находящейся в «теоретическом» вакууме. Можно сказать, что клиническая медицина стала проявлять типичные симптомы ненаучности: избыток фактов и недостаток теории. Ведь суть науки в систематической интеграции данных, а не только в регистрации фактов. Потребность в объяснении накопленных данных вызвала усилия, направленные на создание небольших теорий на очень низком уровне обобщения. Эти отрывочные теоретические концепции малоприменимы даже при интерпретации даже узкой проблематики, так как ведут не к согласованности фактов, а скорее к росту числа новых концепций [6].
Попытки создания серьезных научных теорий с высоким уровнем обобщений явили ещё одну проблему – отбор эмпирических фактов, подтверждающих данную теорию. Следует отметить, что массив накопленных медициной теоретических фактов весьма неоднороден. Он включает исследования как правильно спланированные и выполненные с соблюдением всех требований в строго контролируемых условиях, так и работы, в которых требования к планированию и проведению строго не соблюдались. Тем не менее, оба вида исследований представляют собой научные факты. Для того, чтобы теория имела все признаки «доказательности», факты, отобранные для её подтверждения должны выдержать строгую проверку (верификацию с позиций доказательной медицины) на предмет научной обоснованности. Считается, что только массив эмпирических данных, единых по своим характеристикам (требования к проведению исследований, оценке результатов и достоверности) может стать научной базой для выдвижения той или иной теории. Именно принцип верификации философии позитивизма взяла на вооружение доказательная медицина, правда, придав ему несколько другое значение. Этот принцип в доказательной медицине четко не сформулирован, но рекомендации для определения «доказательности» научных исследований, предлагаемые экспертами доказательной медицины, являются ни чем иным, как верификацией.
Следует отметить, что массив накопленных медициной теоретических фактов весьма неоднороден. Он включает исследования как правильно спланированные и выполненные с соблюдением всех требований в строго контролируемых условиях, так и работы, в которых требования к планированию и проведению строго не соблюдались. Тем не менее, оба вида исследований представляют собой научные факты. Для того, чтобы теория имела все признаки «доказательности», факты, отобранные для её подтверждения должны выдержать строгую проверку (верификацию с позиций доказательной медицины) на предмет научной обоснованности. Считается, что только массив эмпирических данных, единых по своим характеристикам (требования к проведению исследований, оценке результатов и достоверности) может стать научной базой для выдвижения той или иной теории. Именно принцип верификации философии позитивизма взяла на вооружение доказательная медицина, правда, придав ему несколько другое значение. Этот принцип в доказательной медицине четко не сформулирован, но рекомендации для определения «доказательности» научных исследований, предлагаемые экспертами доказательной медицины, являются ни чем иным, как верификацией.
Интересно, что впервые критерии верификации для определения роли инфекционного агента как причины болезни были четко сформулированы Робертом Кохом в 1882 году, т.е. до появления собственно философии позитивизма. Выдвинутая им гипотеза о том, что каждая болезнь имеет одну причину, а конкретная причина вызывает одну болезнь, подтверждалась следующими «протокольными постулатами»:
- Микроорганизм должен быть обнаружен в каждом случае заболевания.
- Микроорганизм должен быть выделен в виде чистой культуры.
- Микроорганизм должен вызывать специфическое заболевание при введении животному.
- Микроорганизм должен быть выделен у больного животного и идентифицирован.
Данный подход способствовал существенному развитию понятия причины в медицине. Постулат о том, что конкретный микроорганизм является причиной заболевания, послужил основой для многих открытий. Однако, для установления большинства болезней недостаточно одних постулатов Коха. Особенно при верификации гипотез заболеваний с множественными, неинфекционными факторами риска.
Формулирование гипотезы предшествует началу любого исследования. Формирование массива данных, служащих для её подтверждения, происходит по следующему примерному алгоритму верификации:
- Вначале разрабатываются критерии поиска информации (статей). Эти критерии представляют собой скрининговый метод отбора необходимой информации. Поиск может осуществляться по ключевым словам, словосочетаниям, фамилиям авторов и т.п. в доступных базах клинических данных (MedLine, Adonis, Cochrane Library).
- Из полученного массива данных необходимо исключить нерелевантные статьи, т.е. информацию не соответствующую критериям поиска. Для этого необходимо изучить название и абстракт статьи, так как контекст использования ключевых слов может быть различен.
- Информация в полученном массиве данных должна быть ранжирована по степени достоверности на основании существующих соглашений медицинской статистики (P?0.95, p?0.05) и критериев достоверности, предложенных экспертами доказательной медицины.
 Согласно мнению Шведского совета по методологии оценки в здравоохранении, достоверность доказательств из различных источников не одинакова, и зависит от типа проведенного исследования. Достоверность убывает в таком порядке:
Согласно мнению Шведского совета по методологии оценки в здравоохранении, достоверность доказательств из различных источников не одинакова, и зависит от типа проведенного исследования. Достоверность убывает в таком порядке:- Рандомизированное контролируемое клиническое испытание;
- Нерандомизированное клиническое испытание с одновременным контролем;
- Нерандомизированное клиническое испытание с историческим контролем;
- Когортное исследование;
- «Случай-контроль»;
- Перекрестное клиническое испытание;
- Результаты наблюдений.
- Центр доказательной медицины в Оксфорде, предлагает следующие критерии достоверности медицинской информации:
- Высокая достоверность – информация основана на результатах нескольких независимых клинических испытаний с совпадением результатов, обобщенных в систематических обзорах.
- Умеренная достоверность – информация основана на результатах по меньшей мере нескольких независимых, близких по целям клинических испытаний.

- Ограниченная достоверность – информация основана на результатах одного клинического испытания.
- Строгие научные доказательства отсутствуют (клинические испытания не проводились) – некое утверждение основано на мнении экспертов.
- Исследователем должно быть четко определено отношение к информации с низкой степенью достоверности. Она может исключаться или не исключаться из исследования, но в любом случае это должно быть особо оговорено.
- На последнем этапе верификации осуществляется анализ содержания отобранных статей, чтобы отсеять те, которые не соответствуют сформулированной в начале исследования гипотезе.
На каждом из этих этапов имеется ряд факторов, оказывающих влияние на ход верификации, и в конечном итоге способных вызвать искажение результатов. Например, на этапе поиска информации могут быть найдены не все значимые источники по интересующей теме из-за плохого индексирования или нежелания фирм-спонсоров публиковать отрицательные результаты клинических испытаний. Сложности корректной трактовки, связанные с различиями в подходах, стандартах и способах оценки также могут оказывать влияние на результат.
Например, на этапе поиска информации могут быть найдены не все значимые источники по интересующей теме из-за плохого индексирования или нежелания фирм-спонсоров публиковать отрицательные результаты клинических испытаний. Сложности корректной трактовки, связанные с различиями в подходах, стандартах и способах оценки также могут оказывать влияние на результат.
Но возможно, что именно в виде подобного алгоритма, доказательная медицина представляет себе логико-методологический анализ медицинского знания, цель которого – формирование базы эмпирических данных в виде фактов науки, представленных языком, не допускающим двусмысленности.
Однако, необходимо отметить, что принцип верификации в философии позитивизма продемонстрировал свою ограниченность, так как наука в основном имеет дело с идеализированными объектами, которые не могут быть верифицированы.
Ограниченность метода верификации особенно заметна при попытке анализа воздействий внешней среды на здоровье человека, где многие факторы находятся в тесной взаимосвязи друг с другом, а степень риска других факторов не установлена. В данном случае результаты верификации могут быть представлены в виде «есть эффект» — «эффект отсутствует» на различных уровнях воздействия в рамках сформулированной теории о факторах риска. Формирование базы эмпирических данных в контексте социально-гигиенического мониторинга является основой для процесса принятия решений в управлении рисками. Основной же проблемой при верификации степени риска факторов внешней среды будет поиск и оценка достоверности данных с позиций медицинской статистики.
В данном случае результаты верификации могут быть представлены в виде «есть эффект» — «эффект отсутствует» на различных уровнях воздействия в рамках сформулированной теории о факторах риска. Формирование базы эмпирических данных в контексте социально-гигиенического мониторинга является основой для процесса принятия решений в управлении рисками. Основной же проблемой при верификации степени риска факторов внешней среды будет поиск и оценка достоверности данных с позиций медицинской статистики.
Подводя итоги, можно сделать заключение, что принцип верификации в доказательной медицине является мощным инструментом установления научной значимости выдвигаемых гипотез. Однако, при его использовании необходимо учитывать, те недостатки, которые обозначили критики позитивизма. В ряде случаев, например, при оценке факторов с окончательно не установленным значением, принцип верификации может стать основополагающим в создании научных теорий.
Литература
- Флетчер Р.
 , Флетчер С., Вагнер Э. Клиническая эпидемиология. Основы доказательной медицины. Пер. с англ. – М.: Медиа Сфера, 1998. – 352 с., илл.
, Флетчер С., Вагнер Э. Клиническая эпидемиология. Основы доказательной медицины. Пер. с англ. – М.: Медиа Сфера, 1998. – 352 с., илл. - Эволюционная эпистемология и логика социальных наук: Карл Поппер и его критики. Составление Д.Г. Лахути, В.Н. Садовского, В.К. Финна. М.: Эдиториал УРСС, 2000.
- Лоун Б. Утерянное искусство врачевания/Пер. с англ. Е. Незлобиной. – М.:КРОН-ПРЕСС, 1998. 367 с.
- Нарский И.С. Современный позитивизм. М., 1961.
- Швырев В.С. Неопозитивизм и проблемы эмпирического обоснования науки. М., 1966.
- Якубик А. Познавательная ценность теории и учение об истерии (Источник – Интернет).
Проведение верификации и аттестационных испытаний медицинского устройства
Разработка медицинского устройства начинается с определения потребностей каждого пользователя, которым будет удовлетворять ваш конечный продукт. Затем эти потребности переводятся в действенные спецификации продукта. Это так называемые проектные входы.
Почему важны входные данные для проектирования? Потому что, если вы не удовлетворите свои требования к дизайну, ваш продукт не удовлетворит потребности пользователей. И если вы не удовлетворяете потребности пользователей, никто не захочет использовать ваш продукт, если и когда он выйдет на рынок.
И если вы не удовлетворяете потребности пользователей, никто не захочет использовать ваш продукт, если и когда он выйдет на рынок.
Но простого включения проектных данных в дизайн вашего медицинского устройства недостаточно. Вы должны следовать надлежащему контролю дизайна и предоставить доказательства того, что вы действительно соответствуете этим спецификациям, и ваш продукт действительно работает для предполагаемых пользователей.
Нанесение этих доказательств на карту является частью проверки и проверки. И хотя все разработчики медицинского оборудования проходят верификацию и валидацию, эти процессы могут быть громоздкими и трудными для понимания.
Чтобы помочь, мы разбиваем как проверку, так и проверку ниже. Кроме того, мы подробно расскажем об инструменте, который поможет вам отслеживать все это.
Понимание процесса проверки медицинского устройства
После того, как вы преобразовываете потребности пользователей в действенные входные данные для проектирования, все заинтересованные стороны продукта должны подписать входные данные для проектирования. Сюда могут входить:
Сюда могут входить:
После того, как все заинтересованные стороны получат ваши проектные данные, начнется фактическая работа по проектированию. Когда вы разрабатываете свое медицинское устройство, вы органично создаете результаты проектирования.
FDA определяет результаты проектирования как:
Результаты усилий по проектированию на каждом этапе проектирования и в конце всей работы по проектированию. Выходные данные готового проекта являются основой для основной записи устройства. Общий результат готового проекта состоит из устройства, его упаковки и маркировки, а также основной записи устройства.
Проще говоря, результаты проектирования — это воплощение ваших проектных данных в дизайне вашего медицинского устройства.
Верификация — это процесс подтверждения того, что ваше медицинское устройство удовлетворяет требованиям проекта. Это требует от вас документирования каждого из этих результатов проектирования, потому что они свидетельствуют о том, что вы выполнили входные данные проектирования.
Обратите внимание, что проверка осуществляется на протяжении всего цикла разработки продукта вплоть до последней утвержденной окончательной проверки проекта непосредственно перед началом производства.
Возможные результаты проверки во время разработки продукта
Существует ряд тестов, которые можно провести в процессе проверки, чтобы подтвердить ваши выходные данные в сравнении с желаемыми входными данными, в том числе:
Термический анализ сборки, чтобы убедиться, что внутренняя или поверхностная температура не превышает установленных пределов
Анализ дерева ошибок процесса или проекта
Анализ видов и последствий отказов,
Проверка целостности упаковки
Испытание материалов на биосовместимость
Тестирование продуктов, подлежащих стерилизации, на бионагрузку
Сравнение дизайна с предыдущим продуктом, имеющим установленную историю успешного использования
Существует ряд протоколов испытаний, определяемых потребностями пользователя, самим продуктом и отраслевыми стандартами, такими как IEC 60601, IEC 62366 и ISO 109. 93, а также стандарты маркировки и программного обеспечения.
93, а также стандарты маркировки и программного обеспечения.
Важно понимать, что хотя квалификационные испытания могут проводиться до проверки и на протяжении всего процесса проектирования. Квалификационные испытания могут обеспечить уверенность в правильности конструкции вашего медицинского устройства.
Некоторые квалификационные тесты дают записываемые результаты проверки. Но в целом лучше всего рассматривать квалификационное тестирование как практику необходимых процессов проверки и подтверждения.
После завершения проверочного тестирования ваши файлы САПР публикуются, и начинается фактическое производство, включая изготовление инструментов и деталей.
Понимание процесса валидации медицинского устройства
Процесс валидации начинается, как только у вас есть детали и узлы, эквивалентные производству, или первые детали оснастки.
В то время как проверка гарантирует, что вы правильно изготовили свое медицинское устройство, проверка подтверждает, что готовый продукт соответствует его предполагаемому использованию в предполагаемой среде.
Возможные валидационные тесты
Процесс валидации часто включает итоговое тестирование удобства использования. Как бы это ни звучало, итоговое юзабилити-тестирование суммирует достижения процесса проектирования путем тестирования системы, похожей на производственную, в конце. В целом, он подтверждает, насколько удобен и безопасен ваш продукт с помощью определенных измерений, снижая риск дорогостоящих сюрпризов.
Допустим, ваш продукт предназначен для использования в экстремально холодных условиях. Суммарный юзабилити-тест предложит пользователю манипулировать и использовать ваш продукт в холодной среде. Вы бы проверили такие детали, как, может ли пользователь держать устройство в руке в рукавицах, не залипают ли петли в экстремальных погодных условиях и так далее.
Если требуются базовые клинические испытания, они также проводятся на этапе валидации разработки медицинского устройства. Основные клинические испытания имеют решающее значение, поскольку их результаты будут оцениваться регулирующими органами (такими как FDA), чтобы определить, является ли ваше медицинское устройство достаточно безопасным и эффективным для перехода к коммерциализации.
Независимо от того, какое тестирование вы проводите во время проверки, знайте, что оно, скорее всего, будет включать множество практических испытаний с реальными пользователями.
Если с процессом проверки все пойдет хорошо, вы подпишете отчет(ы) о тестировании и приступите к реализации своего плана разработки. С другой стороны, если проверка не пройдет успешно, вам придется пересмотреть и, возможно, изменить входные данные для дизайна. Например, вы можете указать в своих инструкциях, что ваш продукт на самом деле не работает, если пользователь носит варежки.
Критическая роль матрицы прослеживаемости в верификации и валидации
Матрица прослеживаемости — это электронная таблица или визуальная карта, показывающая весь список ваших требований (перенесенных в исходные данные для проектирования) и то, как они выполняются во время верификации и валидации.
Хотя большинство компаний, производящих медицинское оборудование, слишком долго не начинают процесс проверки, в идеале вам следует заполнить свою матрицу прослеживаемости, поскольку ваш проект дает результаты, подтверждающие ваши входные данные.
Начав как можно скорее, вы даете себе время для решения любых возникающих проблем до того, как вы зайдете слишком далеко в разработку, чтобы внести изменения в дизайн или продукт. Матрица прослеживаемости помогает отслеживать все в одном легкодоступном месте.
Ваши процессы проверки и проверки будут проходить гладко только в том случае, если вы тщательно задокументируете потребности пользователей и их последующие входные данные для проектирования до того, как вы начнете разработку или рассмотрение проверки и проверки.
Эта статья была первоначально опубликована 23 августа 2021 г. Она была проверена на предмет точности и обновлена 6 июня 2023 г.
Знаете ли вы разницу между проверкой и проверкой?
Верификация и валидация медицинских устройств (V&V) являются важными этапами процесса разработки медицинских устройств. Но в чем разница между ними и зачем они нам нужны? Проверка и валидация необходимы для соблюдения нормативных требований и разработки высококачественного продукта, который приводит к меньшему количеству ошибок, лучшей воспроизводимости, снижению производственных затрат и более быстрому выходу на рынок.
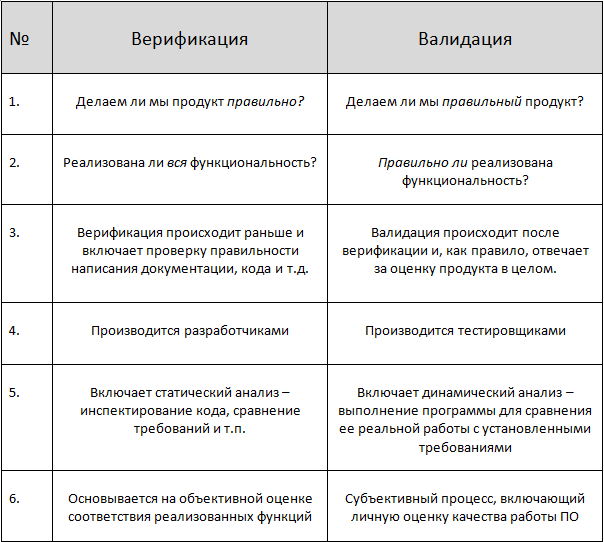
Хотя верификация и валидация являются элементами процесса тестирования медицинского устройства, они выполняют две совершенно разные, но одинаково важные функции. Проще говоря, проверка определяет, был ли продукт создан правильно, а проверка определяет, был ли создан правильный продукт.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов определяет проверку конструкции как «подтверждение путем проверки и предоставления объективных доказательств того, что указанные требования были выполнены». Другими словами, проверка проверяет, соответствуют ли выходные данные вашего проекта вашим входным данным. Верификация, используемая для обеспечения соответствия конструкции медицинского устройства требованиям, обычно включает испытания, проверки и анализ различных уровней и подсистем продукта. Верификация медицинского изделия требует трех элементов: модели, требования и метода.
Имейте в виду, что ваша проверка настолько хороша, насколько хорош предшествующий ей процесс. Если вы сначала пытаетесь понять потребности ваших пользователей, а затем разрабатываете свой продукт на основе этих потребностей и производите выходные данные, отражающие ваши входные данные, ваша проверка дизайна должна пройти гладко. Если на каком-либо из этих шагов произойдет сбой, вы можете столкнуться с дорогостоящими неудачами, которые задерживают время выхода на рынок.
Если вы сначала пытаетесь понять потребности ваших пользователей, а затем разрабатываете свой продукт на основе этих потребностей и производите выходные данные, отражающие ваши входные данные, ваша проверка дизайна должна пройти гладко. Если на каком-либо из этих шагов произойдет сбой, вы можете столкнуться с дорогостоящими неудачами, которые задерживают время выхода на рынок.
Валидация, с другой стороны, представляет собой процесс тестирования, который доказывает, что созданное вами устройство работает так, как задумано потребителем. Согласно определению FDA, это процесс «установления на основе объективных доказательств того, что характеристики устройства соответствуют потребностям пользователя и его предполагаемому использованию», валидационное тестирование может проводиться посредством исследований удобства использования, доклинических исследований или клинических испытаний. В отличие от проверки, которая проверяет устройство на уровне подсистемы, проверка проверяет само устройство или, точнее, взаимодействие пользователя с устройством.
Краткое руководство по различиям между верификацией и валидацией:
| Верификация | Валидация |
|---|---|
| Проверяет, были ли выполнены требования | Проверяет, соответствует ли созданный продукт потребностям потребитель |
| Обнаруживает проблемы на ранних этапах цикла разработки | Обнаруживает проблемы, которые не может выявить процесс проверки |
| Тестирует подсистемы, такие как архитектура программного обеспечения, спецификации, высокоуровневый дизайн и дизайн базы данных | Тестирует реальный продукт |
| Проходит до валидации | Проходит позже в процессе |
| Включает методы статического тестирования | Включает методы динамического тестирования | 901 27
| Внутренний процесс, который используется при разработке или производстве | Внешний процесс, направленный на получение одобрения от пользователей |
Верификация и валидация — это два разных и разных процесса, которые дополняют друг друга при определении того, соответствует ли система или приложение требованиям и соответствует ли они своему предназначению.